La obtención de luz a partir de una reacción química (exotérmica, es decir, que desprende energía) es lo que denominamos quimioluminiscencia, y se produce cuando los electrones de las capas más externas del átomo saltan a las más internas.

Luminol
El luminol (C8H7N3O2) es un compuesto químico polvoriento que es capaz de producir quimioluminiscencia cuando reacciona con algunos agentes oxidantes (habitualmente con peróxidos, que son compuestos cuyos enlaces son oxígeno-oxígeno y exhiben una valencia de -1 en dicho elemento), iluminando con un tono azul que resplandece de una forma digna de ver (lástima que el brillo solo tarde unos 30 segundos).
El producto de la quimioluminiscencia del vídeo inferior resulta de reaccionar dos disoluciones, A y B. La disolución A está compuesta por luminol e hidróxido de sodio o sosa cáustica (NaOH); la disolución B está compuesta por ferricianuro potásico (K3[Fe(CN)6]) y peróxido de hidrógeno o agua oxigenada (H2O2). El luminol y el H2O2 reaccionan y liberan energía fotónica formando la quimioluminiscencia con un color azulado y brillante, mientras que el ferricianuro potásico y el NaOH han actuado como catalizador en la reacción.
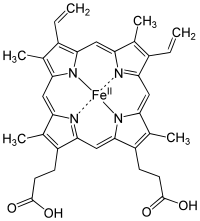
Grupo hemo, donde podemos ver un átomo de Fe en el centro
Esta reacción es muy utilizada en la Ciencia Forense para investigar las zonas de un crimen. Una disolución de H2O2 y de luminol se coloca en la zona donde se sospecha que hay sangre y, si la hay, dicha disolución contactará con el hierro que se encuentra en el grupo hemo de la hemoglobina y actuará como catalizador a la reacción, lo cual la «zona sangrienta» se iluminará de un color resplandor azul durante unos 30 segundos.

Siempre me ha parecido un experimento bastante curioso e interesante que además se puede hacer en casa. Pero ¡cuidado!, que los reactivos contienen toxicidad: por ejemplo, el peróxido de hidrógeno reacciona peligrosamente con algunas sustancias y libera gases irritantes que producen daños en los ojos, quemaduras en la piel, trastornos pulmonares al inhalarlos y/o quemaduras en las mucosas de algunos órganos del aparato digestivo al ingerirlos.
El fenómeno de la quimioluminiscencia también está presente en algunos seres vivos, como las luciérnagas, pero en este caso pasa a llamarse bioluminiscencia, ya que el proceso es natural.
Notas:
1) Este es el primer post de una nueva serie que llevaremos a cabo por Roskiencia, Quimiexperimentos que te llaman, en la cual explicaremos reacciones químicas curiosas (o puede que no lo sean), a ser posible acompañadas de vídeos. ¡Porque la Química también es muy divertida!

2) Este post participa en la XXIII Edición del Carnaval de Química que alojan Luis Reig y Jorge Alemany en el blog Moles y Bits.













Pingback: Bitacoras.com
Pingback: Quimioluminiscencia: el luminol
Pingback: Quimioluminiscencia: el luminol | Artículos CIENCIA-TECNOLOGIA | Scoop.it
Muy bueno, Ismael. La serie de Quimiexperimentos promete. 😀
Gracias, el objetivo es hacer la Química más divertida 😉
Te veo siendo quimiloco 😀
Cuando fui a mi «cole» para hacer experimentos, llevamos este y no salió, lástima ya teníamos captada la atención con CSI… pero a cambio hicimos otros 🙂
Yo también me veo así…
Es que eso de tener un erlenmeyer entre guantes y una bata bien blanca… es enamoradizo 😀
Pingback: Quimioluminiscencia: el luminol | ¿Lo vemos? | Scoop.it
Pingback: Quimioluminiscencia: el luminol | @pepejavier
Pingback: Lo Mejor de la Semana (3-9 de marzo) | Hablando de Ciencia | Artículos
Hola, Ismael me imagino que aun te acuerdas de tu profe de tecnologia del curso pasado. Pues me paso por aqui para felicitarte publicamente por la buen labor que estas realizando con este blog. La verdad es que me he enterado de casualidad porque me lo ha comentado Luis de cc.nnn. . Creo que este tipo de actividades son muy interesantes y nos vuelve a demostrar que todavia hay chavales y chavales con inquietudes y con ganas de aprender. ENHORABUENA y sigue asi. Y si te hace falta cualquier cosa sabes que puedes contar conmigo… en fin pasate por la pag. Web del instituto y por la págna de fb para ver uja reseña que he realizado para felicitarte.
http://m.facebook.com/?_rdr#!/story.php?story_fbid=438072799610476&id=521458574547138&ref=m_notif¬if_t=like&actorid=100000922188581&__user=1479040820
Claro que me acuerdo Alberto 🙂
La Ciencia me apasiona por dos cosas: es la cultura gracias a la que la tecnología avanza y es totalmente curiosa. Muchísimas gracias por la reseña, de verdad.
Un saludo 😀
Pingback: Canaval de Química XXIV. Chrome Edition. | El zombi de Schrödinger
TEMA: LUMINOL.-
Autor: Tito Edgardo Sirlopú Garcés
1.- Concepto
2.-Origen
3.- Aplicación
4.- Resumen
5.-Experimentacion
6.- Con que otro nombre se le conoce.
7.-Preparacion del Luminol
Luminol.
Luminol es un derivado del ácido ftálico. Se trata de un sólido verdoso poco soluble. Su mayor importancia reside en la reacción de quimioluminiscencia que da con peróxidos en presencia de complejos de hierro como catalizadores.
El luminol se utiliza en química forense para detectar trazas de sangre ya que ésta cataliza la oxidación con peróxido de hidrógeno bajo emisión de luz. Esta reacción se lleva a cabo con una solución de luminol diluida en peróxido de hidrógeno. De esta manera se dice que el luminol ha sido «activado» ya que de por sí no se obtiene luminiscencia al contacto con la sangre, si éste no es diluido en el agua oxigenada y aportando un medio básico a través de un hidróxido.
El ácido ftálico (C6H4(CO2H)2) es una sustancia incolora, soluble en agua y en alcohol. Tiene un sistema fenílico con dos grupos carboxi en posición 1 y 2. Su pKa1=2,89 y pKa2=5,50. Su nombre deriva del naftaleno del cual se generaba antiguamente por oxidación. Hoy en día la síntesis se basa en la oxidación del o-xileno
Química Forense
EL LUMINOL
La luminiscencia es un fenómeno producido por las moléculas de materia, que al ser lo suficientemente excitadas, emiten luz visible. Generalmente, la energía proviene de fuentes externas, como es el caso de la electricidad en las lámparas de neón, o el calor proveniente de una combustión. Sin embargo, también es posible producir luz por medio de reacciones químicas, que tienen como ventaja la baja producción de calor, aunque la emisión es bastante breve. Esta es la llamada luz fría
Existen distintos modos de producir luz fría. En este experimento, se explicarán las propiedades de la quimioluminiscencia, con el estudio de las cualidades del luminol. Entre los otros modos de producción de luz fría, se encuentran la fluorescencia, y la fosforescencia. La fluorescencia se debe a la absorción de ondas electromagnéticas de alta frecuencia, y la inmediata emisión de fotones de frecuencia más baja (léase, luz visible), como por ejemplo, en las lámparas de ultravioletas. La fosforescencia consiste en la reemisión progresiva de la energía captada inicialmente por el material, como por ejemplo, en las pantallas de rayos catódicos. En cambio, la quimioluminiscencia es propia de reacciones donde uno de los reactivos recibe una alta excitación, con la posterior emisión de luz visible. En la naturaleza se encuentran varias proteínas quimioluminiscentes, como las presentes en las luciérnagas, los peces de la región abisal, y algunas bacterias. Creadas por el hombre, hay infinidad de compuestos, pero el más usado en la industria y la investigación es el luminol (C8H7N3O2. 5-Amino-1,2,3,4-tetrahidro-phtalazin-1,4-dion).
RESUMEN
El luminol posee la capacidad de enseñar por medio de luz visible, cuando es oxidado. Por esto es una herramienta muy utilizada en la investigación forense, ya que gracias a sus propiedades; puede revelar, en solución con un oxidante, hasta los rastros más ínfimos de sangre, por medio de un brillo azulado. Esta peculiar característica facilita el reconocimiento de aquellas sustancias oxidantes o sus catalizadores en situaciones que requieren rapidez y efectividad, tal como la escena de un crimen donde se demanda el señalamiento de cualquier trazo de sangre.
La reacción del luminol precisa de un medio alcalino, el cual sirve para disolver y cargar negativamente la molécula. El oxidante, que suele ser Peroxido de Hidrogeno, libera y reemplaza dos de los Nitrógenos, llevando así a la molécula a el mencionado estado de excitación.
Finalmente se obtiene el luminol oxidado y cargado, el fotón, y Nitrógeno gaseoso.
Las reacciones de luminol requieren de un catalizador. Usualmente es una sal o metal de transición, los cuales son muy accesibles. Específicamente en el caso de la sangre, el Hierro (Fe) de la Hemoglobina es un poderoso catalizador. Las propiedades de la sangre permiten una excelente optimización de la oxidación del luminol, esta reacción cuenta con la suficiente sensibilidad como para detectar manchas diminutas de sangre, gracias a que puede reaccionar a 1ppm (parte por millón).
EXPERIMENTACION
En el laboratorio se comenzó por demostrar la reacción básica del luminol con varios catalizadores, bases, y oxidantes. Mas adelante se expuso en una solución de agua, una base, y Peróxido de Hidrogeno, solución que fue analizada en sangre y otros compuestos típicos de un hogar que podrían causar confusiones en la detección de sangre. La siguiente tabla ilustra las reacciones y los resultados relativos de cada una.
Se obtuvo una considerable afinidad entre los reactivos, todos reaccionaron de manera inmediata produciendo un brillo azul muy fuerte. Las duraciones variaron mucho, comenzando por la oxidación con blanqueador, la cual solo duraba unos 3 segundos, en los cuales burbujeaba rápidamente el Nitrógeno. Además se obtuvo un brillo muy intenso y puntual.
Las reacciones con Sulfato de Cobre(II) y Hexacianoferrato de Potasio(III) resultaron de gran similitud, se caracterizaron por el mismo color azulado y por una duración de alrededor de 5 minutos. En ambas reacciones fue utilizado el mismo oxidante y medio alcalino, ya que estos actúan de igual manera como catalizadores.
El Nitrato de Cobalto(II) mantuvo el brillo por mas de 20 minutos, decayendo lentamente su intensidad. Su color era un poco más verdoso que el de las demás reacciones. La baja concentración del catalizador demuestra la proporcionalidad de la reacción con esta variable.
Al enfocarse en la reacción con sangre se encontró el brillo mas intenso entre todas las reacciones. Efectivamente cualquier cantidad de sangre, seca o fresca, inclusive hasta una tela y un cuchillo lavados con jabón producían el característico brillo azul, con las minúsculas cantidades de sangre o luminol, el brillo persistía entre 5 y 30 segundos. Al comparar la reacción entre la sangre seca y fresca, el color e intensidad eran iguales, pero la sangre fresca se opacaba un poco más rápido por la espuma blanca producida en la reacción del H2O2 con la sangre, probablemente había un exceso del oxidante. De todas maneras no fue necesario recurrir a proporciones perfectas para crear una solución que detecte la sangre. A partir de luminol, agua, H2O2, y una base cualquiera con pH mayor a 9 (NaHCO3, Na2CO3,y NH3) obtuvimos iguales resultados con la reacción de la sangre. Tan solo se debe precaver en que esta solución solo dura unas horas o días, según la temperatura en que se conserve. Finalmente fue comprobado que la sangre puede diferenciarse de otras sustancias que causan la oxidación del luminol en escenarios comunes de la ciencia forense. Tal como lo es el blanqueador, el cual produce un destello más breve y concentrado que el de la sangre. Los compuestos de origen vegetal, como la mayoría de frutas, no produjeron reacción alguna con el luminol.
¿El químico luminol Tiene otro nombre ?
su nombre más usado es: 3-Aminophthalhydrazide
Alguien sabe como puedo preparar el Luminol?
1. carbonato de sodio.
2. peroxido de hidrogeno.
3. 3-aminoftalohidrazida.
4.agua destilada.
5. ph= 11.5, pero se puede obtener a otros ph, dependiendo el analisis a realizar.
6. Hay ph 12.5, pero ya no permite la prueba de ADN, con la muestra.
7. Finalmente se coloca en un spray, parece ser el mejor metodo.
La formula química del luminol es 5-aminoftalhidracida y produce luz al oxidarse en medio básico y con la acción de un catalizador según la reacción siguiente:
3-aminoftalohidracida + NAOH + H2-02 + Fe (+3)=
3- aminoftalato disodico.
Que en presencia de luz fluorescente, y a oscuras, consigue la excitacion de los atomos del 3-aminoftalato disodico, los cuales emanan fotones, y delinean las manchas de sangre.El luminol es accesible en dos etapas a partir de 3-nitro ácido ftálico e hidracina. El grupo nitro del producto de esta reacción, la hidrazida cíclica del ácido, es reducida después a grupo amino mediante el ditionito de sodio bisulfito sódico.
El efecto catalizador lo tienen también diversos otros complejos de hierro como los hexacianoferratos [[Fe(CN)6]]3- y [[Fe(CN)6]]4-. Con éstos se utiliza el luminol en la fabricación de luces frías químicas.
En las reacciones de bioluminiscencia, como se observa en las luciérnagas y diversos organismos marinos, el papel del luminol lo juegan las luciferinas.
La oxidación del luminol se consigue frecuentemente mediante agua oxigenada, aunque también puede lograrse con permanganatos, hipocloritos, perboratos etc.
El luminol se emplea para detección de las manchas de sangre porque la hemoglobina que contiene la sangre actúa como catalizador. El luminol es tan sensible que puede detectar trazas de sangre hasta una parte por millón, incluso aunque la mancha haya sido previamente lavada o tenga varios años de antigüedad.